Pese a que el Reglamento Delegado (UE) 2016/161 de la Comisión Europea no obliga a la agregación de códigos para la verificación, el Real Decreto 717/2019 de 5 de diciembre abrió la puerta a que dicha agregación pueda incluirse entre los requisitos de los contratos de suministros. De ahí que autoridades y demás agentes implicados en el Sistema Español de Verificación de Medicamentos (Sevem) hayan elaborado «conjuntamente» unas serie de recomendaciones «basadas en estándares internacionales y una operativa de mínimos», para facilitar la adopción de esta funcionalidad y dar homogeneidad a un proceso que, en esta primera fase, solo afectaría a los hospitales, aunque en el documento ya se avanza que habrá una adaptación posterior para oficinas de farmacia.
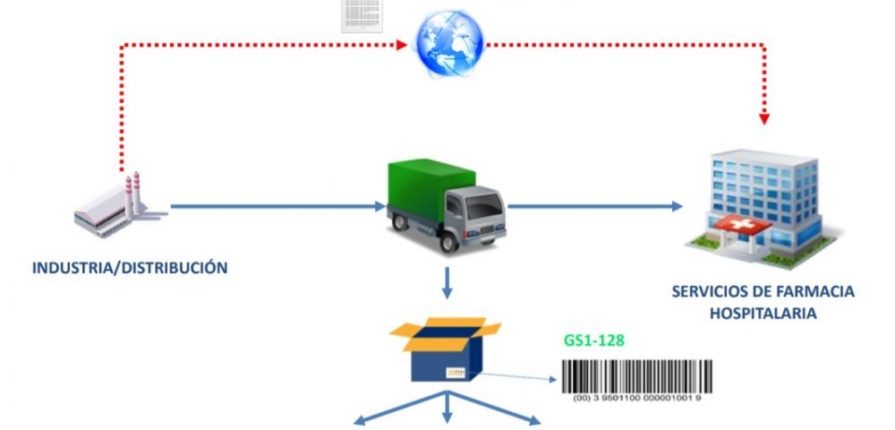
El sistema consensuado se basa en dos elementos principales: un estándar de codificación del fichero electrónico (Desadv, de GS1 Eancom) con los códigos agregados, que se envía directamente del laboratorio al Servicio de Farmacia del hospital, y otro estándar para el etiquetado en el envío de los medicamentos (GS1-128). Ambos estarán vinculados por un código Serial Shipping Container Code (SSCC), que garantizará, dicen, «la trazabilidad entre ambos». «Opcionalmente, podrá requerirse, como medida de seguridad adicional, utilizar un código que figure en el albarán para poder tener acceso a la información del fichero electrónico», aclara el documento.
En el caso del envío del fichero electrónico, deberá garantizarse la confidencialidad e integridad del emisor (laboratorio o distribuidor) y receptor (hospital). Su función básica es la de permitir al Servicio de Farmacia la verificación y desactivación de los códigos, y no deberá utilizarse «para otros cometidos diferentes», según se indica en el texto. Además, laboratorio o almacén deberán garantizar, con un precinto adecuado, que el embalaje exterior no pueda ser manipulado.
Así como laboratorios y, en su caso, almacenes verificarán que la agrupación remitida corresponde al pedido enviado, los servicios de Farmacia deben establecer protocolos para garantizar que la desactivación de identificadores se produce tras comprobar que se han recibido todos los envases de medicamentos de los identificadores a desactivar y, con un muestreo representativo, establecer la correspondencia entre los identificadores desagregados y los envases recibidos.
En cuanto al software del Servicio de Farmacia para leer el fichero de agregación, éste deberá aplicar los procedimientos habituales de comprobación establecidos para los identificadores únicos. Además, para facilitar la operativa en casos excepcionales o errores, debería mostrar, como información básica, la contenida en el identificador (código de producto, lote, fecha de caducidad, número de serie y código nacional), además del nombre del medicamento, según nomenclator, la obligación de verificación del medicamento, la calificación de medicación extranjera, en caso de que aplique, y posibles errores detectados. También es relevante que muestre las comprobaciones realizadas automáticamente o pendientes de validación manual.
Cuando se hayan realizado las correspondientes comprobaciones, se procederá a la desactivación, para lo que se recomienda utilizar la funcionalidad de Mixed Bulk, (servicio web para envío de transacciones en bloque). Una vez enviados los códigos, el responsable de Farmacia deberá esperar al resultado de la desactivación por parte de Sevem y, en caso de detectar alguna alerta, deberán localizarse los envases de los medicamentos afectados y proceder según los procedimientos establecidos por la Aemps.